Équipe-projet Casting : face au cancer, l’union fait la force
Date:
Mis à jour le 10/12/2024
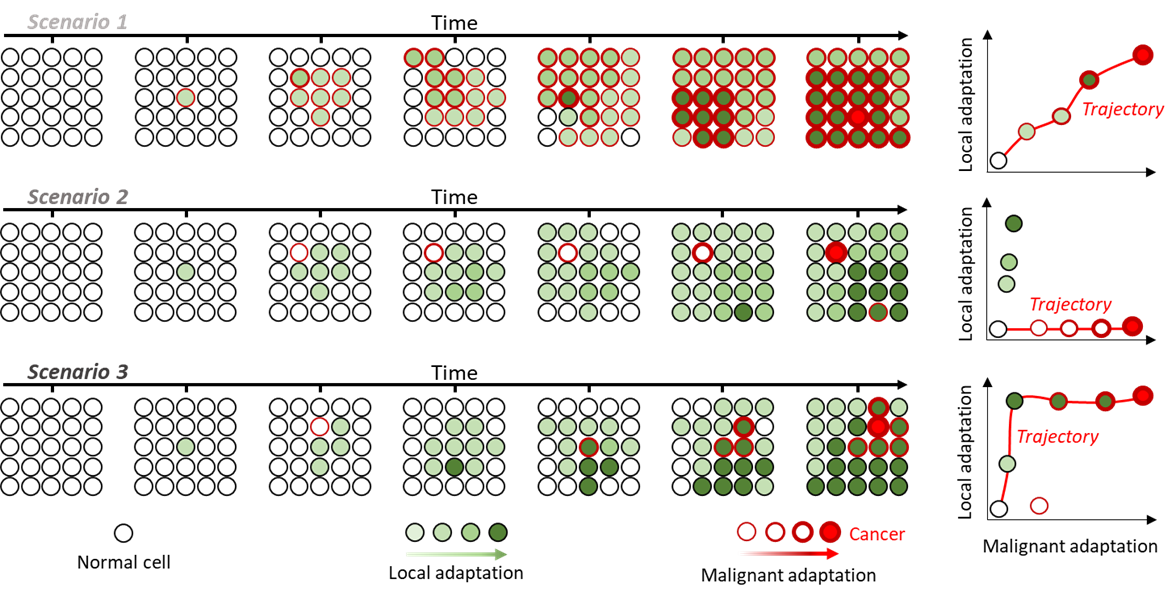
Dissociation de l'adaptation locale et maligne : (Gauche) croissance d'une population finie au fil du temps dans 3 scénarios différents. Les cellules acquièrent des altérations qui affectent différemment leur adaptation (remplissage vert) et leur probabilité de devenir cancéreuses (contour rouge). (Droite) Distribution des scores d'adaptation locale et maligne pour chaque clone et les trajectoires menant de l'état normal à l'état cancéreux en rouge.
Le cancer tue 10 millions de personnes par an d’après l’OMS, et au moins 100 000 chercheurs dans le monde travaillent sur cette maladie. Comment aborder le sujet sous un nouvel angle ? C’est le défi relevé par l’équipe-projet Casting (Cancer ecosystem dynAmicS, adapTation and modelING), basée à Lyon. Créée officiellement le 1er juin 2024 et commune à Inria, l'Inserm, le Centre Léon Bérard, le CNRS, l'Université Claude Bernard Lyon 1 et l'ENS de Lyon, elle compte à ce jour 12 permanents. Son approche est doublement originale. D’abord, elle consacre une bonne part de son activité à l’évolution des tissus sains vers des « prénéoplasies » - des états précancéreux - et au risque d’évolution de ces prénéoplasies vers des tumeurs malignes établies ; alors que ces dernières monopolisent l’essentiel des travaux de recherche, sur tous les continents.
Seconde spécificité de Casting : elle réunit des experts de différentes disciplines qui d’habitude, ne collaborent que ponctuellement ou le temps d’un projet commun.
Associer modélisation mathématique, biologie computationnelle, biologie expérimentale et médecine dans une même équipe, c’est rare, confirme Hélène Leman, chercheuse Inria et co-responsable de Casting. Nous nous consacrons au même sujet sous quatre angles complémentaires, avec des finalités, des données et des méthodes alignées, et en affinant l’analyse jusqu’au niveau cellulaire. On peut espérer ainsi de belles avancées dans la compréhension des mécanismes d’évolution des tissus sains et des tumeurs.
Quelles avancées ? D’abord, une estimation précise du potentiel de transformation maligne des prénéoplasies. « Sur les cancers que nous étudions, ceux des voies aérodigestives supérieures potentiellement exposées ou non au tabac, rien ne permet aujourd’hui de quantifier ce risque, explique le professeur Pierre Saintigny, médecin chercheur spécialisé dans la lutte contre le cancer au Centre Léon Bérard à Lyon et co-responsable de l’équipe. On met en place une surveillance pour tous les patients, alors qu’une minorité d’entre eux seulement évolueront vers un cancer. »
Mieux comprendre l’évolution des prénéoplasies permettra aussi d’identifier de possibles cibles thérapeutiques. D’autres chercheurs pourront alors développer des traitements pour empêcher l’évolution maligne, si elle est jugée probable. Ainsi, les politiques de dépistage et de suivi des patients à risque seront plus efficaces.
Pour autant, dans ses travaux de recherche, Casting ne délaisse pas complètement les tumeurs cancéreuses établies. L’équipe s’attache à comprendre pourquoi des métastases réduites et inactivées par une chimiothérapie se « réveillent », des mois ou des années après.
« Le traitement crée une pression sélective et certaines cellules y résistent, puis se développent à nouveau, décrit Pierre Saintigny. Un peu comme un boxeur sonné temporairement par un coup qui parviendrait à reprendre le combat après un temps variable. Nous devons comprendre ce qui se joue au niveau cellulaire dans de tels cas, afin d’améliorer les thérapies appliquées à ces rechutes. »
En pratique, comment les membres de l’équipe organisent-ils leur collaboration ? « Le mot-clé, c’est le dialogue, répond Hélène Leman. Une chercheuse en mathématiques se rend régulièrement au centre Léon-Bérard pour travailler aux côtés de ses collègues cliniciens. Pour ma part, je questionne beaucoup mes collègues biologistes et médecins pour concevoir des modèles qui ciblent les phénomènes pertinents, je valide ces modèles avec les données qu’ils me fournissent, etc. »
En parallèle, les experts de chaque discipline mènent leurs propres recherches. Par exemple, les spécialistes de la biologie computationnelle partent d’échantillons prélevés sur des patients pour réaliser du séquençage à très haut débit, puis récupérer la totalité des gènes qui ont subi des mutations dues au cancer, ainsi que les ARN messagers qu’ils expriment. L’ensemble est ensuite représenté dans des modèles réalistes très complexes : « Ces derniers doivent refléter fidèlement les phénomènes biologiques et biochimiques qui se produisent, précise Pierre Saintigny. Nous pouvons ainsi en déduire des mécanismes d’évolution des tissus sains, prénéoplasiques ou cancéreux ».
Comprendre ce qui se joue, c’est aussi l’objectif des chercheurs en modélisation mathématique. Grâce aux échanges avec les biologistes, ils déterminent les types de cellules et d’interactions entre cellules qui tiennent un rôle prépondérant. Ces scientifiques travaillent à différentes échelles : celle des cellules pour représenter les mutations, celle des tumeurs pour reproduire leurs variations de taille… Ils font aussi les liens entre ces différentes échelles.
« L’enjeu, c’est d’obtenir un modèle le plus fidèle possible à la réalité, d’estimer précisément ses marges d’erreur et d’en tirer des résultats exploitables, résume Hélène Leman. Exemples : quelle est la probabilité de récidive sur une tumeur bien spécifique traitée précédemment par chimiothérapie, ou le risque de transformation maligne d’un type donné de prénéoplasie ? »
Enfin, les chercheurs mènent des expériences in vitro, in vivo et ex vivo pour observer comment des cellules, des tissus ou des modèles animaux réagissent à diverses molécules thérapeutiques : constate-t-on l’apparition d’une tolérance ou d’une résistance ? À quelle vitesse les populations de cellules se développent-elles ?
« Combiner et coordonner ces expertises au sein d’une même équipe constitue un pur plaisir intellectuel, sourit Pierre Saintigny. C’est aussi le moyen d’aboutir à des publications très originales. Nos chercheurs en ont déjà rédigé deux, l’une en théorie mathématique et l’autre sur la pression de sélection des cellules malignes induite par les traitements. »
Certains s’étonneront de l’absence de l’IA dans la panoplie d’outils de Casting. « Elle est très performante pour prédire des phénomènes, répond Hélène Leman, mais beaucoup moins pour les comprendre et les décrire. D’autant qu’elle utilise des modèles en mode boîte noire : nous obtenons des résultats sans forcément savoir de quel raisonnement ils sont issus. » Toutefois, il existe des compétences en IA au sein de l’équipe. Elles entreront en scène dans un second temps, sur des objectifs complémentaires ; par exemple, comparer virtuellement l’efficacité de différentes séquences de traitements.